研究概要
遺伝子の塩基配列変化を伴わない、DNAメチル化に代表される塩基配列の化学修飾様式(エピジェネティクス)は、私たち哺乳類の細胞における分化、細胞アイデンティティーの維持に重要な役割を果たしています。エピジェネティクスによる遺伝子発現調節機構(エピゲノム制御)はiPS細胞樹立に代表されるような細胞運命転換や組織の再生にも中心的な役割を果たすことが示されつつあります。一方で、がん細胞や老化細胞において、エピゲノム制御の異常が観察され、エピゲノム制御の変化が発がんや個体老化過程にも関与していることが明らかになりつつあります。
我々は、マウス発生工学およびエピゲノムを制御可能なリプログラミング技術を駆使して、マウス生体内で細胞運命の摂動を誘発可能なマウス(Reprogrammableマウス)を作製しています。Reprogrammableマウスの解析により、一つの受精卵から始まる細胞の分化や、個体レベルでの恒常性維持機構など、様々な生命現象におけるエピゲノム制御の理解を目指しています。
Project 1
マウス発生工学、リプログラミング技術を駆使したがん研究
発がん過程において、塩基配列の異常を伴わない、エピジェネティック異常が、重要な役割を果たしていることが明らかになりつつあります。がん細胞にリプログラミング技術を応用し、がん細胞でのエピゲノム制御状態を積極的に変化させることで、がん細胞における真のエピゲノム制御異常を同定し、その意義を明らかにしようとしています(Cell 2014, Stem Cell reports 2016, PNAS 2017, Nature Commun. 2018, Nature Commun. 2019, Nature Commun. 2021)。がん細胞では、しばしば「脱分化」という現象が観察され、細胞初期化過程との類似性が注目されています。しかしながら、「脱分化」がどのように発がん過程に関与しているのかについては、明らかになっていません。我々は「脱分化」、「細胞初期化」に関わるエピゲノム制御と発がんとの関連を明らかにします。また、遺伝子配列変異に依存しない細胞分化の異常による発がん過程の検証を行います。さらに、がん細胞の運命転換に着目した抗がん剤スクリーニング技術を開発しています(Cell Reports 2022)。日本発のiPS細胞技術とマウス発生工学を駆使した独創的ながん研究の展開を目指しています。
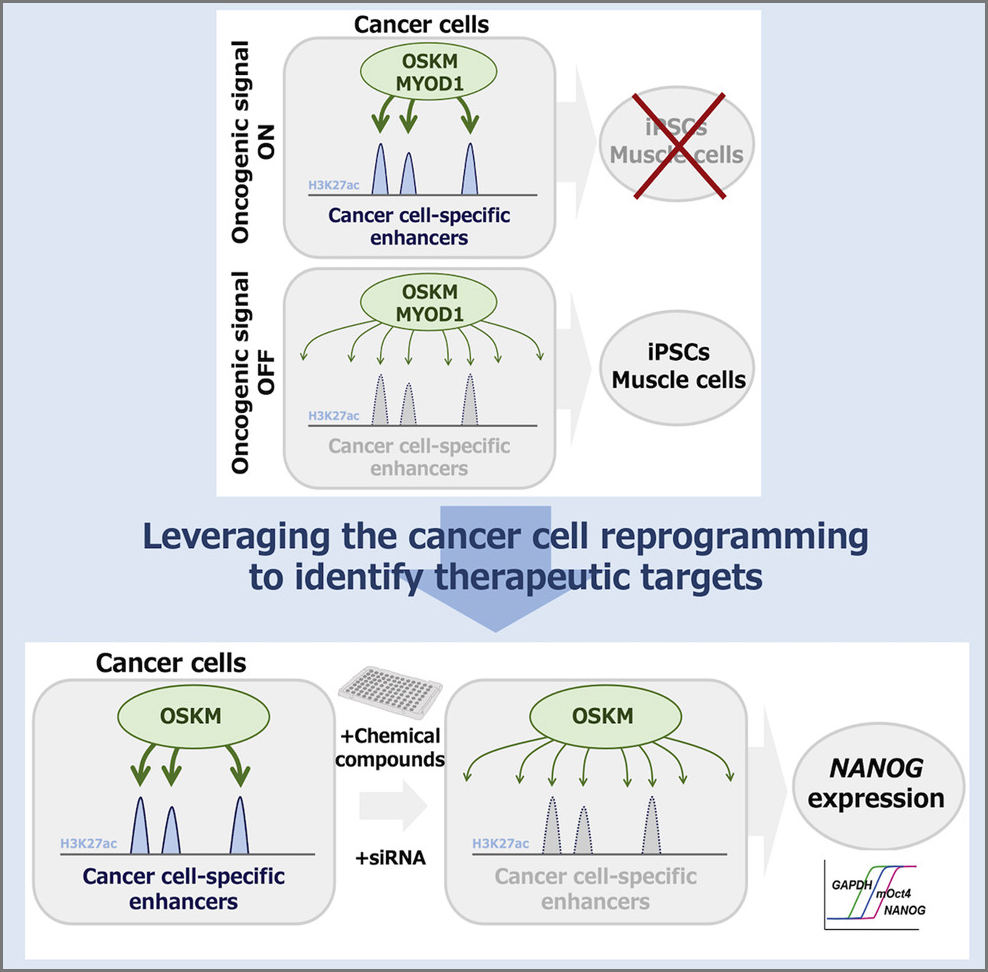
Ito et al. Cell Reports 2022
Project 2
生体内リプログラミングシステムを使った、個体レベルでの組織再生、若返り誘導に関する研究
我々はマウス個体内でiPS細胞が誘導可能な生体内細胞初期化システム(Reprogrammableマウス)を開発しました(Cell 2014)。近年、Reprogrammableマウスを応用して、細胞老化や、組織再生、さらには個体の若返りに関する興味深い知見が明らかになりつつあります。様々なReprogrammableマウスを開発し、生体内での細胞運命転換過程を解析することで、個体レベルでの老化や組織再生の分子基盤を明らかします(Cell Stem Cell 2017)。さらには、それらの知見を応用した革新的な組織再生方法や若返り誘導方法の開発を目指しています。
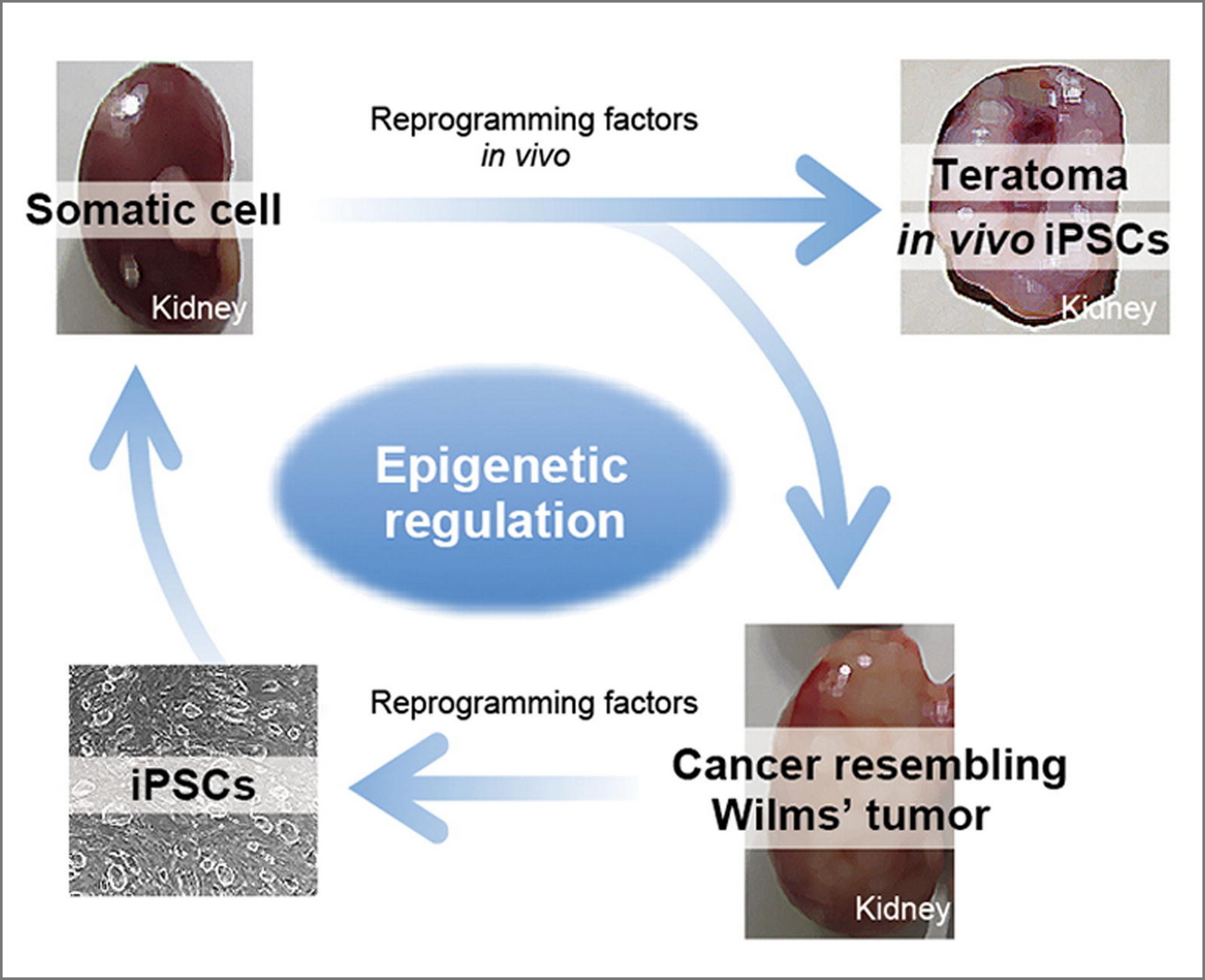
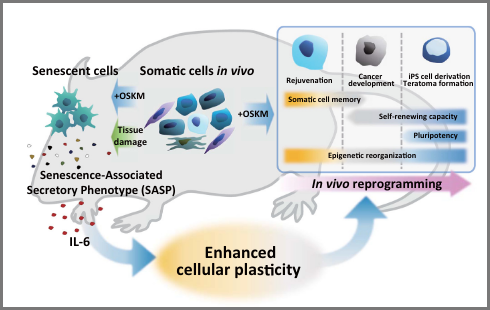
Ohnishi et al. Cell 2014 Taguchi et al. Cell Stem Cell 2017
Project 3
糖尿病根治を目指した膵島細胞の増幅技術の開発、運命転換制御機構の解明
我々はMycl遺伝子によるリプログラミング技術を開発し、成熟膵島細胞を増幅させることに成功しました(Nature Metabolism 2022)。この結果を応用して、試験管内での膵島細胞の増幅による膵島移植治療や、生体内での膵島細胞を標的とした遺伝子治療による成熟膵島細胞の増殖誘導を目指しています。また、遺伝子改変技術と網羅的エピゲノム解析を融合させることで、増幅膵島細胞や老化細胞におけるエピゲノム制御機構の理解を深化させます。最終的には、リプログラミング技術による膵島細胞の再生医療の開発や老化膵島の機能回復技術の開発を目指します。
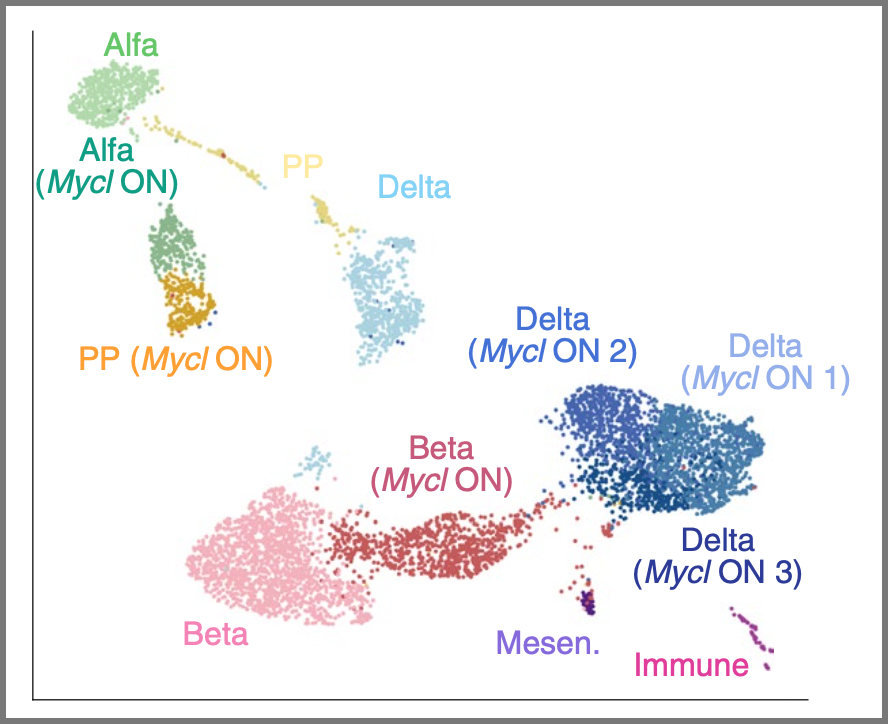
Hirano et al. Nature Metabolism 2022
ページトップ
